材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。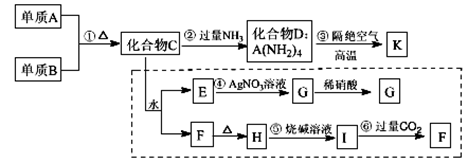
请回答下列问题:
(1)实验室通常用MnO2制取气体B,发生该反应的化学方程式为 ,为防止气体B污染环境通常
用 (填化学式)溶液吸收,反应的离子方程式为
(2)化合物H与碳混合加强热可制得单质A,该反应中氧化剂与还原剂的物质的量比为
(3)写出反应③的化学方程式3D==K+8X↑,K的化学式为 ,X的化学式为 。
(4)K抗腐蚀能力很强,但易被氢氟酸腐蚀,K与氢氟酸反应生成一种气体和一种盐,此盐中存在的化学键类型有 。
(5)写出反应②的化学方程式 。
【有机化学基础】某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其相对分子质量为118,其核磁共振氢谱图中有5个峰,峰面积之比为1:2:2:2:3,其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题:
(1)A的结构简式为 。
(2)E中的官能团名称是 。
(3)C的结构简式为 。
(4)反应②、⑥的反应类型分别是 。
(5)反应⑤、⑧生成高分子化合物的反应原理是否相同? 。
(6) 两分子E可以脱去2分子水,形成一种环状化合物,写出该反应的化学方程式: 。
(7)写出反应④的化学方程式: 。
(8)满足下列条件的G的同分异构体有 种。
①苯环上有两个取代基;②能发生银镜反应;③加入FeCl3溶液显色。
[化学——选修5:有机化学基础]
已知:
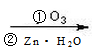
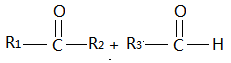
烃A,分子内苯环上一氯代物只有2种同分异构体,现有如下转化关系。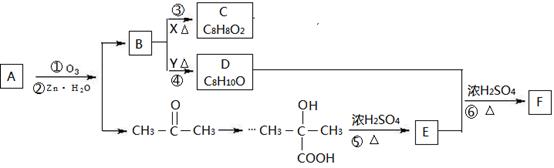
(1)E中官能团为___________________(结构简式)。
(2)A的结构简式_______________;试剂X可以为___________________。
(3)反应⑥的化学方程式______________________________________________________。
(4)F可以发生聚合反应,化学方程式___________________________________________。
(5)写出E的同分异构体的结构简式:①与C具有相同官能团;②不含甲基。
_______________________________________________________________________________。
姜黄素醚A具有比姜黄素更好的抗肿瘤的作用,从乙二醇合成姜黄素及姜黄素醚A的路线如下:
回答下列问题:
(1)姜黄素的含氧官能团为 、 和羰基(填官能团的名称)。
(2) ①和②反应类型分别为 、 。
(3) 写出同时满足下列条件的G的一种同分异构体的结构简式 。
I.分子含有苯环;II.分子有5个不同化学环境的氢;
III.能与FeCl3溶液发生显色反应;Ⅳ.能发生水解反应,且能发生银镜反应。
(4) B的结构简式为: 。
(5)已知:
请写出以乙烯和丙烯为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
下图为某药物合成路线的一部分。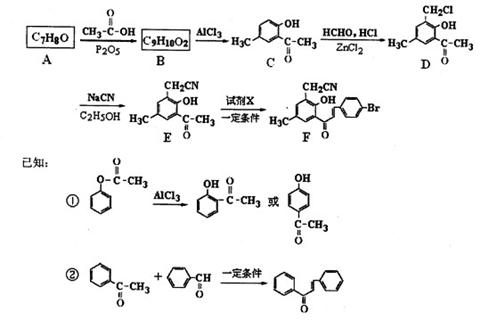
(1)A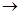 B的化学方程式为。E中的含氧官能团名称为、。
B的化学方程式为。E中的含氧官能团名称为、。
(2)若②的反应历程经历了中间产物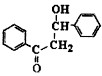 ,则该反应历程先后经历的反应类型为、。试剂X的结构简式为。
,则该反应历程先后经历的反应类型为、。试剂X的结构简式为。
(3)写出两种满足下列要求的D的同分异构体的结构简式。
①分子中有4种化学环境不同的氢原子;
②可发生水解反应,一种产物可发生银镜反应,另一种能与FeCl3发生显色反应;
③分子中的氯原子不与苯环直接相连。,。
有机物G(分子式为C10H16O)的合成设计路线如下图所示:
已知:ⅰ
ⅱ
ⅲ
请回答下列问题:
(1)35%~40%的A的水溶液可做防腐剂,A的结构式为。
(2)C中官能团的名称为。
(3)C2H4生成C2H5Br的反应类型为。
(4)D的结构简式为。
(5)E为键线式结构,其分子式为。
(6)G中含有1个五元环,F生成G的反应方程式为。
(7)某物质X:
a.分子式只比G少2个氢,其余均与G相同
b.与FeCl3发生显色反应
c.分子中含有4种环境不同的氢
符合上述条件的同分异构体有种。
写出其中环上只有两个取代基的异构体与A在酸性条件下生成高分子化合物的方程式。