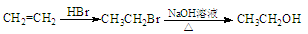H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):
①
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2: 。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出生成F与足量氢氧化钠溶液在加热条件下反应的化学方程式 。
(5)写出E在铜催化下与O2反应的化学方程式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构),其中核磁共振氢谱为5组峰的为 (写结构简式)。
(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)写出下列元素的元素名称:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是______________________。
某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液;
(2)向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀盐酸;
(4)将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
(5)将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中①肯定含有_______,②不能确定是否含有 _________,③一定不含有_______。
实验室用固体烧碱配制0.1 mol /L的NaOH溶液500 mL,回答下列问题:
(1)计算需要NaOH固体的质量g。
(2)有以下仪器和用品:①烧杯②药匙③250 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平。配制时,必须使用的仪器或用品有(填序号),还缺少的仪器是。
(3)使用容量瓶前必须进行的第一步操作是。
(4)配制时,一般分为以下几个步骤:① 称量② 计算③ 溶解④ 摇匀⑤ 转移⑥ 洗涤⑦ 定容,
其正确的操作顺序为。
(5)配制过程中,下列操作会引起结果偏高的是(填序号)。
① 未洗涤烧杯、玻璃棒② NaOH溶液未冷却至室温就转移到容量瓶并定容
③ 容量瓶不干燥,含有少量蒸馏水④ 称量NaOH的时间太长⑤ 定容时俯视刻度
药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下:
A能使三氯化铁溶液显色。
完成下列填空:
(1)写出A的结构简式:_____________;CH3I的作用___________________。
(2)反应④的化学方程式____________________________________。
H的一种同分异构体的一氯代物的结构为 ,该物质在NaOH水溶液中加热反应时的化学方程式为 。
,该物质在NaOH水溶液中加热反应时的化学方程式为 。
(3)试写出能同时满足以下条件H所有的同分异构体 。
a.能与氯化铁溶液发生显色反应 b.能与碳酸氢钠反应产生无色气泡
c.取0.1mol有机物能与足量Na反应能产生3.36L(标况下)气体
d.苯环上的一氯代物只有两种,但苯环上氢原子数不少3
e.分子中含有甲基
(4)试利用CH3CH=CH2为原料制备 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图例如下: