(12分)高氯酸钾广泛用于火箭及热电池业。实验室制取高氯酸钾的步骤为:称取一定质量的KCl、NaClO4溶解,然后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到。
有关物质溶解度与温度的关系如下表: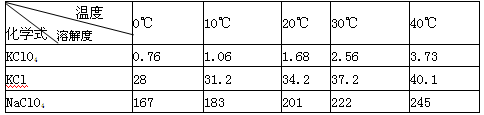
(1)写出实验室制取高氯酸钾的化学方程式: ;用蒸馏水多次洗涤晶体的目的是: 。
(2)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,这类电池称为热电池。Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为: 。
(3)Fe和KClO4作为热电池加热材料的供热原理为:KClO4 (s)+4Fe(s)=" KCl" (s)+ 4FeO(s),△H< 0。
①600℃时FeO可部分分解生成Fe3O4,写成有关的化学方程式: 。
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体。求该加热材料反应前,铁和高氯酸钾的质量。(写出计算过程,结果保留2位有效数字) 。
A、B、C、X是中学化学中常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。请回答下列问题:
(1)若X是强氧化性单质,则A不可能是__________(填序号)
A.CB.N2C.SD.Mg E.Al
(2)若A能使湿润的红色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程式为_________________。若B是一种常见的温室气体,则B转化为C的化学方程式。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B的化学式为____________。保存C溶液常加入少量X,其目的是________________________________。
(4)若A、B、C均为含有铝元素的化合物,若X为NaOH溶液,则A与X生成B的离子方程式_____________________________;若X为稀硫酸,则A与X生成B的离子方程式________________。
写出下列除去杂质所用的试剂和对应的离子方程式:
(1)FeCl2溶液混有FeCl3杂质,除杂试剂___________,离子方程式_________________________。
(2)CO2气体混有HCl杂质,除杂试剂_____________,离子方程式____________________________。
(3)NaHCO3溶液混有Na2CO3杂质,除杂试剂________,离子方程式___________________________。
(4)NO中混有NO2杂质,除杂试剂_____________,离子方程式_______________________________。
将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式:。
(2)生成的氨气在标准状况下的体积是L。
(3)若将这些氨气溶于水配成500mL氨水,该氨水的物质的量浓度是mol·L-1。
(4)在400℃左右且有催化剂存在的情况下,用氨可以把一氧化氮还原成氮气,方程式为:4NH3+6NO=5N2+6H2O,此反应中氧化产物与还原产物的物质的量之比为。
在下图转化关系中,已知B、D都是淡黄色固体,请回答下列问题。
⑴写出下列物质的化学式:B,G。
⑵写出下列反应的化学方程式:
A→B:;E→F:;B→C:。
⑶将过量气体E通入到下列各组溶液后,离子仍能大量共存的是。
A.Ba2+、Ca2+、Cl-B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl- D.H+、Fe3+、NO3-
硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
⑴写出反应容器B中发生反应的化学方程式:。
⑵吸收塔C中通入空气的目的是;C、D两个反应容器中发生的反应,属于氧化还原反应的是(填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:。
⑷金属铜与稀硝酸反应的离子方程式是,该反应中稀硝酸表现的性质是。