设NA为阿伏加德罗常数的值。下列说法正确是
| A.标准状况下,2.24 L三氯甲烷中含有碳氯共价健的数目为0.3NA |
| B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| C.常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA |
| D.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA |
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
| A.某温度下,测得溶液的pH < 7 |
| B.溶液中c(Na+)=c(A2-) |
| C.溶液中存在Na+、HA-、A2-、 H2A 多种微粒 |
| D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应 |
下列叙述正确的是
| A.常温下,反应C(s) + CO2(g)=2CO(g)不能自发进行,则该反应△H>0 |
| B.强电解溶液的导电能力一定强于弱电解质溶液的导电能力 |
| C.CH3COOH、Cu(OH)2、BaSO4、NH3都是常见的弱电解质 |
| D.常温下就能发生的化学反应一定是放热反应 |
常温下,将C1 mol·L-1的盐酸和C2 mol·L-1的氨水等体积混合,下列叙述错误的是
| A.c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| B.当C1= C2时,c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.当pH=7,一定是C2>C1 |
| D.当pH<7,一定是C1=C2 |
下列有关物质的量浓度关系正确的是
A.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.0.1 mol·L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-)
关于下列各装置图的叙述中,不正确的是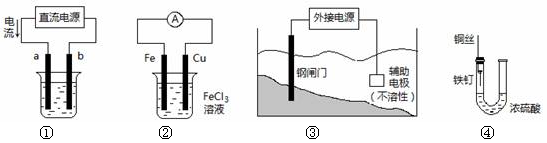
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置③中钢闸门应与外接电源的负极相连 |
| C.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| D.装置④中的铁钉几乎没被腐蚀 |