氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。
(1)“调节pH=4”可选用的试剂是 (填编号)。
①MgO ②CuO ③MgCO3 ④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是 。
(3)“滤渣”的主要成分为 。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;② ;③ ;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是 。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2•6H2O的质量分数为 。
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: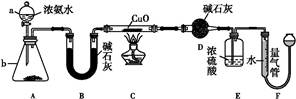
(1)仪器a的名称为 ;仪器b中可选择的试剂为 。
(2)实验室中,利用装置A,还可制取的无色气体是 (填字母)。
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有 性,写出相应的化学方程式: 。
(4)E装置中浓硫酸的作用是 。
(5)读取气体体积前,应对装置F进行的操作: 。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)。
现要测定某氯化亚铁和氯化铁混合物中铁元素的质量分数,按以下步骤进行实验:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式: 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是 。
若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定: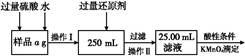
(1)溶解样品改用了硫酸,而不再用盐酸,为什么? 。
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是 。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: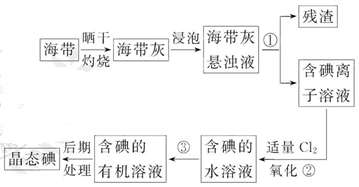
(1)步骤①的实验操作名称是_________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是_________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是_________;
| A.CCl4与水不互溶 |
| B.CCl4可与I2发生取代反应 |
| C.CCl4的密度比水大 |
| D.CCl4不易燃烧,可作灭火剂 |
E.碘在CCl4中的溶解度比在水中大很多
(4)步骤③中还可选择_________作萃取剂;
(5)步骤②中反应的离子方程式是__________________________________;
(6)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________。
某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。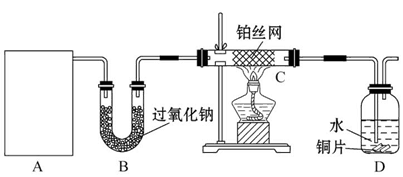
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是_________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为_________ (选填下列仪器编号,固定装置省略)。
(2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①_______________________________________________________________;
②_______________________________________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用是__________________________________________________;
②写出C中发生反应的化学方程式: ________________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有_________________。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________。
(2)另取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后收集到气体Y。
甲同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为______。
【探究二】
分析上述实验中SO2体积分数的结果,乙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是_________________________________________。
(4)认为气体Y中还含有Q的理由是______________________________。(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于______(选填序号)。
a.A之前 b.A、B间 c.B、C间 d.C、D间
(6)如果气体Y中含有H2,预计实验现象应是____________________________。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28 mL H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由________。