(12分)周期表前四周期的元素A、B、C、D、E,原子序数依次增大。A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,B与C同周期,且C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)E+离子的基态核外电子排布
(2)B、C、D中第一电离能由大到小的顺序为 (填元素符号)
(3)A和B、C两元素形成的两种共价化合物发生反应,生成BA4+离子,该离子的中心原子的杂化方式为 ;与BA4+离子互为等电子体的一种分子为 (填化学式)。
(4)E的硫酸盐溶液中滴加过量的氨水可以生成配合物[E(NH3)4]SO4,1 mol配合物中含有的σ键的数目为 。
(5)E和C(空心小球为C,实心小球为E)形成的一种离子化合物的晶体结构如图所示,则离子化合物的化学式为 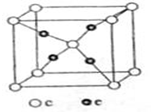
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2 2CO+O2
2H2+O2 2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_________和_________,或_________和_________ (填它们的化学式)。
(2)若平衡时O2和CO2的物质的量分别为n平(O2)="a" mol,n平(CO2)="b" mol。试求n平(H2O)="________" (用含a、b的代数式表示)。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: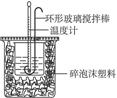
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:______________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如上图)。
容器中发生以下反应:N2+3H2 2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此回答下列问题:
2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此回答下列问题:
(1)保持上述温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积分数仍与上述平衡时完全相同。那么:①若a=1,c=2,则b=_________,在此情况下,反应起始时将向_____________(填“正”或“逆”)方向进行。
②若需规定起始时,反应向逆方向进行,则c的范围是___________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是______________________________。
在一固定容积的密闭容器中,在一定条件下进行以下化学反应:A(g)+2B(g) 3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
3C(g)。已知加入1 mol A和3 mol B,且达到化学平衡后,生成了a mol C。
(1)达到化学平衡时,C在反应混合气中物质的量百分含量为_________(用字母a表示)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到化学平衡后,C的物质的量为________mol(用字母a表示)。此时C在反应混合气体中的物质的量的百分含量_________(填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,并要求达到化学平衡后C在反应混合气体中的百分含量不变,则还应加入C_________mol。
在容积可变的密闭容器中,可逆反应2HI(g) H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
H2(g)+I2(g)已达平衡,若将体积缩小,在缩小的过程中:
(1)正反应速率______________;
(2)逆反应速率______________;
(3)平衡______________;
(4)容器内颜色______________;
(5)H2的质量分数______________;
(6)混合气体的平均相对分子质量______________;
(7)H2的浓度______________;
(8)HI的分解率______________;
(9)混合气体的密度______________;
(10)混合气体的质量______________。(用“变大”“变小”“不变”“加深”“变浅”填写)