700℃时,向容枳为2L的密闭容器中充入一定量的CO和H2O发生反应:
CO(g)+H2O(g) 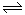 CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见表。下列说法正确的是
| A.反应在t1min内的平均速率为v (H2)=0.4/t1 mol·L-1·min-1 |
| B.其他条件不变,起始时向容器中充入0.60molCO和1.20 mo1H2O,到达平衡时,n(CO2)="0.40" mol |
| C.其他条件不变,向平衡体系中再通入0.2molH2O,达到新平衡时CO转化率减小 |
| D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
以下反应属于吸热反应的是
| A.生石灰加水制熟石灰 | B.氢氧化钡晶体与氯化铵晶体混合 |
| C.氢氧化钠溶液中滴加稀盐酸 | D.化石燃料的燃烧 |
下列说法中错误的是
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
下列说法正确的是()
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
C.第三周期非金属元素含 氧酸的酸性从左到右依次增强 氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
下列化学用语表示正确的是()
A.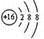 为Cl-的离子结构示意图 为Cl-的离子结构示意图 |
B. 为HClO的电子式 为HClO的电子式 |
C.H2S  H ++ HS- 为氢硫酸的电离方程式 H ++ HS- 为氢硫酸的电离方程式 |
| D.O =" C" =" O" 为二氧化碳分子的结构式,该分子中含有非极性键 |