(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):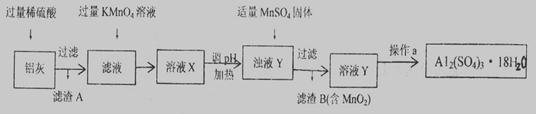
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是________________________。
操作a由一系列操作组成,分别是________、________、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①____________②___________________
制备AgI胶体的做法是:取一支大试管,注入0.01 mol/L KI溶液10mL,用胶头滴管滴入8~10滴相同浓度的AgNO3溶液,边滴入边振荡。KI+AgNO3=AgI(胶体)+KNO3
简要回答下列问题:
(1)为什么要用稀的KI溶液和稀的AgNO3溶液?
____________________________________。
(2)为什么要缓慢地滴加AgNO3溶液于KI溶液中?并且还要边振荡?____________________________________。
在Cu(NO3)2和AgNO3的混合溶液中加入一定量的锌粉,使之充分反应后,有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质是。
(2)若反应后过滤,向所得固体物质加盐酸没有气体产生。则溶液中一定有,可能有。
(3)若反应后过滤,向滤液中滴加NaCl溶液,有不溶于稀硝酸的白色沉淀生成,则此时溶液中含有的溶质为。
写出下列物质的化学式,并进行物质的分类(按单质、酸性氧化物、碱性氧化物、酸、碱、正盐、酸式盐、碱式盐)。
(1)磷酸、;(2)纯碱、;
(3)铜绿、;(4)小苏打、;
(5)硝酸亚铁、; (6)氩、。
有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液.现将有关实验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙液中,先出现凝聚,后液体变清,则甲为 ,乙为 ,丙为 ,丁为 。
X、Y、Z分别是Fe、Cu、Hg、Ag四种金属元素中的一种,X的单质能从Y的盐溶液中置换出Y,但不能从Z的盐溶液中置换出Z,也不和稀盐酸反应。Z的单质也能够从Y的盐溶液中置换出Y,但不能够置换出盐酸中的氢。
(1)三种金属的活动性由强到弱的顺序是______________________。
(2)若X是Hg,则Y是___________,Z是___________。
(3)写出Z和Y的硝酸盐溶液发生反应的化学方程式___________(Y、Z用相应的元素符号表示)。