下列有关说法正确的是
A.已知:HI(g) 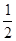 H2(g)+ H2(g)+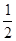 I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 |
| B.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol |
| C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知 2H2O(g)+ O2(g)=2H2O2(l)△H=+108.3kJ/mol① N2H4(l) + O2(g)=N2(g) + 2H2O(g)△H=-534.0kJ/mol② 则有反应:N2H4(l) + 2 H2O2(l) =N2(g)+ 4H2O(l)△H=-642.3kJ/mol |
| D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) = CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ/mol |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2、H2SO4 |
K2SO4 、MnSO4...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- ...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4-> Cl2 > Fe3+ > Br2
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| A.非金属性:T<X <R |
| B.气态氢化物稳定性:R <T<Q |
| C.R与Q的电子数相差16 |
| D.X与Q最高价氧化物的水化物的质子数相差18 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是
| A.贝诺酯分子可与6molH2完全反应 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D.乙酰水杨酸和对乙酰氨基酚均可与NaHCO3溶液反应 |
NA表示阿伏加德罗常数的值,常温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是
| A.反应前气体的总体积为0.448L |
| B.生成物中含有0.01NA个分子 |
| C.装置中氢元素的总质量为0.04g |
| D.生成物完全溶于水后所得溶液含有0.01 NA个NH4+ |
25℃时,下列溶液中水的电离程度最小的是
| A.0.01 mol/L NaHSO4 | B.0.1 mol/L Na2CO3溶液 |
| C.pH = 4盐酸溶液 | D.pH =11氨水 |