一定条件下,氨气和氟气可以发生反应:4NH3+3F2 → NF3+3NH4F,其中NF3分子空间构型与NH3相似。下列说法错误的是
| A.NF3是由极性键构成的极性分子 |
| B.氧化产物只有NF3,还原产物有NF3和NH4F |
| C.4 mol NH3被氧化时转移电子的物质的量为6 mol |
| D.NH4F属于离子晶体,既含有离子键又含有共价键 |
在其它条件一定时,图中曲线表示反应:2NO(g)+ O2(g) 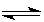 2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是()
2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是()
A. A点或E点 B. B点 C. C点 D. D点
下列可逆反应达平衡后,升高温度可使混合气的平均分子量增大的是 ( )
A.N2(g)+3H2(g)  2NH3(g);△H<0 2NH3(g);△H<0 |
B.H2(g)+I2(g)  2HI(g);△H<0 2HI(g);△H<0 |
C.2SO3(g) 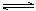 2SO2(g)+O2(g);△H>0 2SO2(g)+O2(g);△H>0 |
D.4NH3(g)+5O2(g) 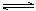 4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
下列热化学方程式书写正确的是( )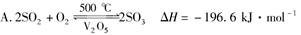
B.H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
X、Y是周期表前二十号元素 ,已知X、Y之间原子序数相差3 ,X、Y能形成化合物M ,下列说法正确的是 ( )
| A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体 |
| B.若X的单质常温下是气体,则Y的单质常温下也是气体 |
| C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种 |
| D.若M属于离子化合物,则其中可能含有非极性键 |
短周期主族元素A、B、C的原子序数依次递增,它们的族序数之和为11,A、C同主族,B原子最外层电子数比A原子次外层电子数多l。下列叙述不正确的是()
A.原子半径:B>C>A
B.A、C两元素的最高价氧化物对应水化物的酸性A强于C
C.C的最高价氧化物只能与碱反应,不能与任何酸反应
D.B的最高价氧化物的熔点比A的最高价氧化物的熔点低