根据右表,以下错误的是
| 酸 |
HF |
H3PO4 |
| 电离常数 |
Ki =" 3.6×10" - 4 |
Ki1=" 7.5×10" -3 Ki2=" 6.2×10" -8 Ki3=" 2.2×10" -13 |
A.NaF和H3PO4反应的产物只有HF、NaH2PO4
B.0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4
C.0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L
D.25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者
下列叙述中正确的是
| A.以Al作阳极,Fe作阴极,可以实现铁上镀铝 |
| B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 |
| C.向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 |
| D.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
| A.正极反应式:Ca+2Cl--2e-=CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.常温时,在正负极间接上电流表或检流计,指针发生偏转 |
| D.每转移0.1 mol电子,理论上生成10.35 g Pb |
下列表示对应化学反应的离子方程式正确的是
| A.醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+ |
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.惰性电极电解MgCl2溶液:Cl-+2H2O = 2OH-+H2↑+Cl2↑ |
下列物质转化在给定条件下能实现的是
A.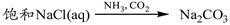 |
B.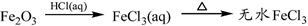 |
C.Al2O3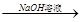 NaAlO2溶液 NaAlO2溶液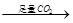 Al(OH)3 Al(OH)3 |
D. |
下列装置或操作能达到实验目的的是
① ② ③ ④
| A.装置①可用于证明SO2与NaOH溶液发生了反应 |
| B.若装置②中X为CCl4,可用于吸收氨气或氯化氢 |
| C.装置③可用于实验室从食盐水中提取氯化钠 |
| D.装置④可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯 |