(本题共12分)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=  Q(Q>0)。
Q(Q>0)。
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
29.写出该反应的平衡常数表达式__________________________________________。
30.前2s内的平均反应速率υ(N2) = mol/(L·s);达到平衡时,CO的转化率为 。
31.下列描述中能说明上述反应已达平衡的是________________
A.2υ正(NO)=υ逆(N2)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的转化率不再发生变化
32.采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,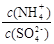 的值将 (填“变大”、“不变”或“变小”)
的值将 (填“变大”、“不变”或“变小”)
33.有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是________________(填编号);
34.向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象__________________________________________________________。
写出NaHCO3在水溶液中所发生的电离与水解反应的离子方程式,
并写出溶液中的电荷守恒的表达式
溶液中的物料守恒(即原子守恒)的表达式
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)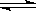 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
升高温度CO2的转化将(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: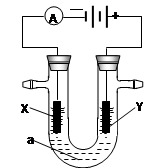
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应为。
在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。
检验该电极反应产物的方法是。
常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示):。
(2)混合溶液中由水电离出的c(H+)(填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)=mol·L-1,c(OH-)-c(HA)=mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列:(填序号)。
在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:
Cr2O72—+H2O 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈色,因为。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈色,
因为。