将一镁铝合金(含0.1 molMg,0.2 molAl)完全溶于由0.2 molNH4Cl和1 molHCl组成的混合溶液中,在反应后的溶液中慢慢加入Na2O2粉末,加热排出气体,则加入Na2O2的量和生成气体及沉淀的量的关系正确的是
| |
A |
B |
C |
D |
| Na2O2(mol) |
0.2 |
0.4 |
0.6 |
0.7 |
| 沉淀(mol) |
0 |
0.2 |
0.3 |
0.1 |
| 气体(mol) |
0.3 |
0.4 |
0.5 |
0.6 |
下列实验事实不能证明醋酸是弱酸的是( )
| A.常温下,测得醋酸钠溶液的pH>7 |
| B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
将0.05  的醋酸溶液加水稀释时,下列说法正确的是( )
的醋酸溶液加水稀释时,下列说法正确的是( )
| A.溶液中氢氧根离子的浓度增大了 |
B.c 减小,电离平衡向生成醋酸分子的方向移动 减小,电离平衡向生成醋酸分子的方向移动 |
| C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少 |
D.电离程度增大,c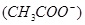 也增大了 也增大了 |
下列关于FeCl3水解的说法错误的是 ( )
| A.水解达到平衡时(不饱和),加氯化铁达饱和溶液,溶液的酸性会增强 |
| B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| C.有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小 |
| D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是()
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1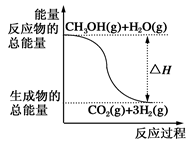
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
如图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是 ( )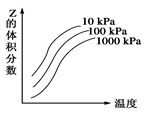
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气体 |
| C.X和Y中只有一种为气态,Z为气态 |
| D.上述反应的逆反应ΔH>0 |