浓硫酸在加热条件下能溶解金属银,反应的化学方程式为2Ag +2H2SO4(浓)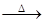 Ag2SO4 +SO2↑+2H2O,下列反应中浓硫酸的作用与该反应相同的是
Ag2SO4 +SO2↑+2H2O,下列反应中浓硫酸的作用与该反应相同的是
A.Cu + 2H2SO4 (浓) 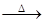 CuSO4 + SO2 ↑+ 2H2O CuSO4 + SO2 ↑+ 2H2O |
B.C +2H2SO4 (浓)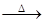 CO2 ↑ + 2SO2↑+ 2H2O CO2 ↑ + 2SO2↑+ 2H2O |
| C.2FeO+ 4H2SO4 → Fe2(SO4)3+SO2↑+ 4H20 |
D.C2H5OH +2H2SO4 (浓)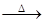 2C + 2SO2↑+ 5H2O 2C + 2SO2↑+ 5H2O |
下列各组变化中,ΔH或Q前者小于后者的一组是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②在稀溶液中:含0.5 mol H2SO4硫酸与含1 mol NaOH的溶液混合:H+(aq)+OH-(aq)=H2OΔH1
NaOH(aq)+CH3COOH(aq) =CH3COONa(aq)+H2O(l)ΔH2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3 (s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
| A.①②③ | B.②③ | C.①② | D.①③④ |
下列说法正确的是()
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
| B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
D.在其 他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡:Cl2+H2O HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g)  H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
C.反应CO+NO2  CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2 2NH3;△H<0) 2NH3;△H<0) |
下列说法正确的是()
| A.pH<7的溶液一定是酸性溶液 |
| B.改变外界条件使溶液中c(H+)增大,则其pH增大 |
| C.室温下,每1×107个水分子中只有一个水分子发生电离 |
| D.常温时,pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍 |
下列叙述中一定能判断某化学 平衡发生移动的是()
平衡发生移动的是()
| A.混合物中各组分的浓度改变 | B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 | D.混合体系的压强发生改变 |