某未知溶液可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和K+。取100mL该溶液进行实验,过程记录如下。由此可知原溶液中
| A.一定有Cl- | B.一定有CO32- | C.一定没有K+ | D.一定没有Mg2+ |
25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是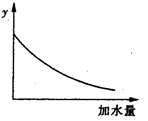
| A.溶液的pH | B.醋酸的电离平衡常数 |
| C.溶液的导电能力 | D.醋酸的电离程度 |
下列说法正确的是
| A.在Na2CO3、NaHCO3两溶液中,离子种类不相同 |
| B.在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等 |
| C.在NaHCO3和Na2CO3混合溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| D.在NaHCO3和Na2CO3混合溶液中一定有:2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)] |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.1.0 mol/L Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+)+ 2c(H2CO3) |
| B.1.0 mol/L NH4Cl溶液:c(NH4+) = c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) >c(CH3COO-)>c(H+)>c(OH-) |
| D.1 mol/L CH3COONa溶液,c(CH3COO-)=" 1" mol/L |
常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示。下列结论正确的是
| A.酸B比酸A的电离度大 |
| B.A为弱酸,B为强酸 |
| C.酸B的物质的量浓度比A的小 |
| D.A酸比B酸易电离 |
向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42-)时,溶液的pH
| A.等于7 | B.大于7 | C.小于7 | D.无法判断 |