除去被提纯物质中的杂质,方案正确的是
| 编号 |
被提纯的物质 |
杂质 |
除杂试剂 |
除杂方法 |
| A. |
CO2 (g) |
SO2(g) |
饱和Na2CO3溶液、浓H2SO4 |
洗气 |
| B. |
NaCl(s) |
KNO3(s) |
AgNO3溶液 |
过滤 |
| C. |
苯 |
苯酚 |
浓溴水 |
过滤 |
| D. |
苯 |
甲苯 |
KMnO4(酸化),NaOH溶液 |
分液 |
逻辑推理是化学学习常用的思维方法。下列推理正确的是
| A.酸性溶液的pH都小于7,所以酸溶液pH一定小于7 |
| B.有机物都含碳元素,所以含碳元素的化合物都是有机物 |
| C.水是纯净物,所以海水也是纯净物 |
| D.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应 |
下列各项比较中,正确的是
| A.含碳量:生铁>钢 | B.熔点:铁<汞 |
| C.氢氧化钙的溶解度:80℃>20℃ | D.核外电子数:钠原子<钠离子 |
下图是部分被污损的某白色固体药品标签。为探究其成分,取样滴入适量盐酸,无气泡产生。则该固体
| A.一定是NaCl | B.一定是NaNO3 |
| C.可能是Na2CO3 | D.可能是Na2SO4 |
下列实验操作错误的是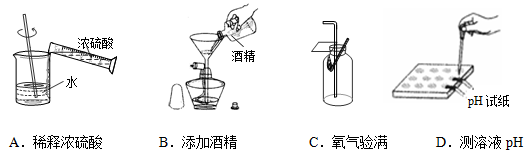
下列实验现象的描述正确的是
| A.硫在空气中燃烧产生蓝紫色的火焰 |
| B.将一定量的硫酸铵和熟石灰在研钵中研磨,可闻到氨臭气味 |
| C.加热碱式碳酸铜时,绿色粉末变成光亮的红色的铜 |
| D.在一磨光的石灰石板上滴几滴盐酸,产生二氧化碳气体,石灰石表面变粗糙 |