有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg ,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
| A.A点时加入氢氧化钠溶液体积为20 mL |
| B.室温时0.01 mol/L的醋酸溶液pH=4 |
| C.OA段溶液中:c(CH3COO-)> c(CH3COOH) |
| D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) + c(H+) = c(OH-) |
下列化学实验事实及解释都正确的是
| A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力 |
B.等体积、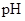 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: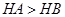 |
| C.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数 |
D.向浓度均为0.1 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。 |
下列离子方程式不正确的是
A.硫氢化钠水解HS- + H2O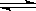 H2S + OH- H2S + OH- |
B.加热氯化铝溶液至干Al3+ + 3 H2O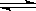 4Al(OH)3 + 3H+ 4Al(OH)3 + 3H+ |
| C.硫酸铝溶液与偏铝酸钠溶液反应Al3+ + 3AlO2- + 6H2O =4Al(OH)3↓ |
D.醋酸的电离HAc+H2O 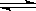 H3O+ +Ac- H3O+ +Ac- |
现已知:2H2(g)+O2(g)=2H2O(l),⊿H=-572kJ/mol;H—H键的键能为436kJ/mol;O="O" 键的键能为498kJ/mol,则H2O分子中O—H键的键能为
| A.485.5 kJ/mol | B.610 kJ/mol | C.917 kJ/mol | D.1220 kJ/mol |
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
在一定温度下的定容密闭容器中,下列说法能表明反应:A(s)+2B(g) 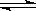 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.混合气体的压强不变 | B.消耗2molB的同时生成1molC | C.混合气体的相对分子质量不变 | D.气体的总物质的量不变 |