A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示。X位于元素周期表中第四周期ⅠB族。请回答下列问题:
(1)D单质晶体中原子的堆积方式为体心立方堆积,其配位数是 。DAB3中阴离子的立体构型是 。中学化学常见微粒中,与晶体D3AB4中阴离子互为等电子体的分子有 (任写一种)。
(2)X2+离子的电子排布式为______,X2+离子与水分子形成的配离子[X(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[X(H2O)2(Cl)2]具有极性的分子的结构__________。
(3)A元素分别能与硼、铝形成相同类型的晶体,但是A与硼形成晶体的熔点更高,其原因是 。
(4)AC3的沸点比氨的沸点低得多,原因是 。
(5)若E与C形成的晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3 (用NA表示阿伏伽德罗常数的值,写出表达式即可)。
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。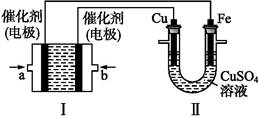
(1)a处应通入 (填“CH4”或“O2”),b处电极上发生的电极反应式是 ;
(2)电镀结束后,装置Ⅰ中溶液的pH (填“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 ;
(3)电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有 (忽略水解);
(4)在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(1)据报道,科研人员新近开发出一种由甲醇和氧气以及强碱作电解质溶液的新型电池,可供手机连续使用一个月。据此请回答以下问题:
①甲醇是 极,电极反应是 。
②电池反应的离子方程式是 。
(2)一般说来,根据一个氧化还原反应便可设计一个原电池。例如,某种燃料电池的总反应是CH4+2O2+2OH- C+3H2O。在此燃料电池中,通CH4极是 极,通O2极是 极,每消耗1 mol CH4,转移电子 mol,此电池的电解质溶液为 ,负极发生的电极反应是 ,正极发生的电极反应是 。
C+3H2O。在此燃料电池中,通CH4极是 极,通O2极是 极,每消耗1 mol CH4,转移电子 mol,此电池的电解质溶液为 ,负极发生的电极反应是 ,正极发生的电极反应是 。
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。如图是钒电池基本工作原理示意图: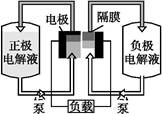
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是 ,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是 。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、V)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O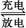 +V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
+V+2H+。放电时的正极反应式为 ,充电时的阴极反应式为 。放电过程中,电解液的pH (选填“升高”“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是 。
a.V、VO2+混合液
b.V3+、V2+混合液
c.V溶液
d.VO2+溶液
e.V3+溶液
f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是 。
Zn MnO2干电池应用广泛,其电解质溶液是ZnCl2
MnO2干电池应用广泛,其电解质溶液是ZnCl2 NH4Cl混合溶液。
NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2 NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O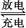 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。