关于下列各图的叙述正确的是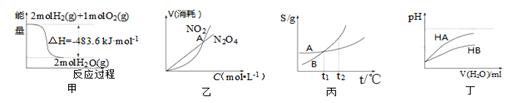
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准燃烧热为△H=-483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
科技日报2007年1月30日讯美、德两国科学家日前成功合成出具有独特化学性制质的氢铝化合物(AlH3)n,其结构类似于由B和H组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6的球棍模型如图。下列有关说法肯定不正确的是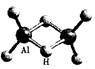
| A.Al2H6中H为+1价,Al为-3价 |
| B.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C.Al2H6分子是非极性分子 |
| D.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
运用元素周期表分析下列推断,其中错误的是
| A.铍是一种轻金属,它的氧化物的水化物可能具有两性 |
| B.单质砹是一种有色固体,砹化氢很不稳定,砹化银是有色难溶于水且感光性很强的固体 |
| C.硫酸锶是难溶于水的白色固体 |
| D.硒化氢是无色、有毒,比硫化氢更稳定的气体 |
几种短周期元素的原子半径及主要化合价见下表
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
下列叙述正确的是
| A.L、M的单质与稀盐酸反应的反应速率:M>L |
| B.R的氧化物对应的水化物可能具有两性 |
| C.T的气态氢化物分子间存在氢键 |
| D.L、Q形成的简单离子核外电子数相等 |
下列变化规律错误的是
| A.微粒半径:F-<Cl-<Br-<I- | B.稳定性:HI<HBr<HCl<HF |
| C.沸点:HF<HCl<HBr<HI | D.阴离子还原性:F-<Cl-<Br-<I- |
下列图示正确的是
A.氟化氢的电子式: |
| B.次氯酸的结构式:H—Cl—O |
C.铝离子的结构示意图: |
D.氯化铯的晶体结构(晶胞)模型: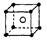 |