某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:已知HNO2是一种不稳定的弱酸,易分解生成NO2和NO,AgNO2是一种不溶于水的白色沉淀。
①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol·L-1的硫酸溶液恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
Fe3+有氧化性 |
Fe 2(SO4)3可作净水剂 |
| B |
浓硫酸有腐蚀性 |
常温下浓硫酸不能用铁罐盛装 |
| C |
Cl2是非金属单质 |
Cl2能使湿润的有色布条褪色 |
| D |
熔融状态的Al2O3中有自由移动的Al3+和O2- |
电解熔融状态的Al2O3制备Al |
合成二甲醚的三步反应如下:
2H2(g) + CO(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
2CH3OH (g) CH3OCH3 (g) + H2O(g) ΔH2
CH3OCH3 (g) + H2O(g) ΔH2
CO(g) + H2O (g) CO2(g) + H2(g) ΔH3
CO2(g) + H2(g) ΔH3
则 3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g) 的ΔH是
CH3OCH3(g) + CO2(g) 的ΔH是
| A.ΔH=2ΔH1+ΔH2+ΔH3 | B.ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH=ΔH1+2ΔH2+2ΔH3 | D.ΔH=2ΔH1+ΔH2—ΔH3 |
下列说法正确的是
| A.青铜、碳素钢和石英都是合金 |
| B.陶瓷、玻璃和水泥都是无机非金属材料 |
| C.乙醇与乙醛互为同分异构体,都能发生银镜反应 |
| D.油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
常温下,下列关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+) = c(Cl−) + c(ClO−) + c(OH−) |
| B.pH = 8.3的NaHCO3溶液:c(Na+)>c(HCO3−)>c(CO32−)>c(H2CO3) |
| C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH−) = c(CH3COO−) – c(CH3COOH) |
| D.向硝酸银溶液中逐滴滴加物质的量浓度相等的氯化钾和铬酸钾的混合溶液,若先产生白色的氯化银沉淀,则有:Ksp(AgCl)<Ksp(Ag2CrO4) |
在不同温度下,水溶液中c(H+)与c(OH-)有如下图所示关系。下列关于离子共存说法中正确的是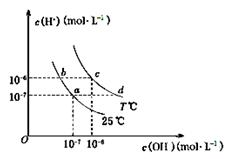
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42— |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3— |
| D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl- |