将3.20 g Cu跟30.0 mL 10 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
| A.(0.1+a)mol | B.2a mol | C.0.1a mol | D.0.5a mol |
下列化学反应ΔH最大的是
| A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1 |
B.NaOH(aq)+ H2SO4(aq)= H2SO4(aq)= Na2SO4(aq)+H2O(l);△H2 Na2SO4(aq)+H2O(l);△H2 |
| C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3 |
D.NaOH(aq)+ H2SO4(浓)= H2SO4(浓)= Na2SO4(aq)+H2O(l);△H4 Na2SO4(aq)+H2O(l);△H4 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是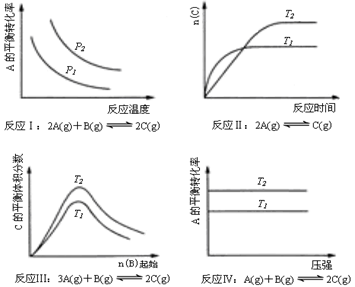
| A.反应Ⅰ:△H>0,P2>P1 | B.反应Ⅱ:△H<0,T1>T2 |
| C.反应Ⅲ:△H>0,T2<T1 | D.反应Ⅳ:△H<0,T2>T1 |
将2mol SO2和2mol SO3气体混合于固定容积的容器内,在一定条件下,发生反应:2SO2 + O2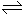 2SO3,达平衡时SO3为n mol。相同温度下分别按下列配比,平衡后SO3的物质的量大于n mol的是
2SO3,达平衡时SO3为n mol。相同温度下分别按下列配比,平衡后SO3的物质的量大于n mol的是
| A.2mol SO2和1mol O2 |
| B.2mol SO2和1mol O2和2mol SO3 |
| C.4mol SO2和1mol O2 |
| D.3mol SO2和0.5mol O2和1mol SO3 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是 ( )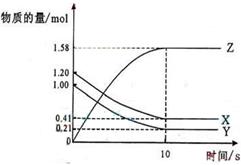
| A.反应开始到10s,用Z表示的反应速率0.158mol/(L·s) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g) Z(g) Z(g) |
在密闭容器中进行下列反应:M(g)+N(g) 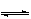 R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是()
R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是()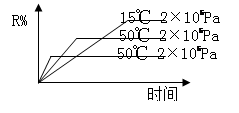
| A.正反应为吸热反应,X为气体 |
| B.正反应为吸热反应,X为固体或液体 |
| C.正反应为放热反应,X为气体 |
| D.正反应为放热反应,X为固体或液体 |