水通常是可用来灭火的,但有时水却是可引火的。同学们将少量超氧化钾(KO2)粉末用棉花包裹没有任何变化。(已知棉花和超氧化钾不反应)但如果将少量水滴到包有超氧化钾粉末的棉花上,则棉花迅速发生剧烈的燃烧(比在空气中燃烧还剧烈)。同学们对此产生好奇,在老师的指导下,完成了如下实验探究。
【提出问题】 。
【猜想与假设】1.超氧化钾和水反应生成 。2. 。
【设计与实施】为了验证猜想,有同学提出如下实验方案:向盛有KO2的试管中滴加适量水,若看到有气泡产生,证明猜想1成立。在上述实验的试管口拴上一个气球,若气球变鼓,证明猜想2成立。你是否同意该实验方案,你的理由是 。
在老师的指导下,同学们又进一步完善该方案并用下图所示装置进行实验验证。
【实验结论】超氧化钾与水发生的化学反应,满足了棉花燃烧的条件。
某无土栽培营养液的配方中可能含有氯化钾、硫酸铵、碳酸氢氨中的一种或几种物质,为确定配方的成分,化学兴趣小组的同学开展了以下探究活动:
(1)【实验探究一】取少量固体样品在研体中与熟石灰混合研磨,有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变色,写出可能发生该反应的一个化学方程式。
(2)【实验探究二】另取少量固体样品溶于水得到溶液A,按下图所示进行实验,现象如图所述(设发生的反应都恰好完全进行).请你回答下列问题: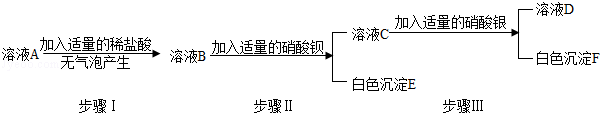
①白色沉淀E是。
②小明认为由实验探究二可以确定该化肥中一定含有氯化钾和硫酸铵,一定没有碳酸氢铵。小强认为这个结论不正确,他的理由。为了使小明的结论正确,小强对上述实验进行了改动,他的做法是。
在实验课中,各小组作了如下实验:
| 实验编号 |
1 |
2 |
3 |
4 |
| 实验操作 |
 |
 |
 |
 |
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜。经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同。
则固体C是,操作③的名称是,实验中所加的过量金属粉末是。
对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
| 实验内容 |
实验现象 |
分析与结论 |
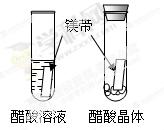 |
醋酸晶体试管内 (1),醋酸溶液试管中镁带表面冒气泡。 |
酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字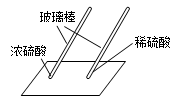 |
(2)(填“浓”或“稀”)硫酸使白纸炭化。 |
即使是同种酸,由于(3) 不同,它们的性质不完全相同。 |
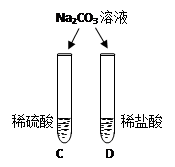 |
两试管中均产生(4) |
不同的酸具有相似的性质,这是因为酸的组成中都含有(5)(填元素符号)。 |
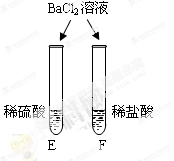 |
E试管中产生(6) , F试管中无明显现象。 |
不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为(7) 。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有(8) (填化学式)。
金属材料在国防建设中起着量要的作用,图1为歼﹣15飞机在辽宁舰上起飞
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是、。
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的共同作用的结果,工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为。
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是。
②实验二中,若出现现象,可证明铁的活动性强于铜,该反应的化学方程式为。
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg)。
①装置A中生成铁的化学方程式为,装置B中发生反应的化学方程式为。
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是。
实验室要制取一瓶纯净、干燥的二氧化碳气体,请根据以下装置回答下列问题。
(1)发生装置应选(填写装置的字母代号)。
(2)用F装置而不用E装置收集二氧化碳的原因是。
(3)若用G装置来收集二氧化碳,气体应从端进入(填a或b)。
(4)若要用C装置来干燥二氧化碳,C装置中应盛放的物质是。
(5)D装置通常用来除去二氧化碳中混有的少量氯化氢气体,请写出化学方程式。