以下方法可用于工业冶炼金属的是
| A.电解熔融AlCl3获取金属铝 | B.电解MgCl2溶液获取金属镁 |
| C.用CO还原铁矿石来获取金属铁 | D.电解饱和食盐水来获取金属钠 |
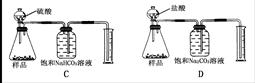
现有一工业纯碱样品(含少量氯化钠等不与酸反应的杂质),用如图装置测定样品中碳酸钠的质量分数,其中正确的是
某溶液含有①NO、②HCO、③SO、④CO、⑤SO等五种阴离子。向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化)
| A.① | B.①②④ | C.①③⑤ | D.①③④⑤ |
物质的用途和该物质的性质密切相关。下列关于物质性质与用途的叙述错误的是
| A.钨丝能承受高温,受热能够发光,可制造灯丝 |
| B.钛制品非常轻,却非常坚固,不易变形,可用于制造人造卫星和太空飞船的部件 |
| C.硅的导电性介于导体和绝缘体之间,可制造晶体管和集成电路 |
| D.铅无毒,抗蚀能力又高,可制造罐头筒 |
下列有关铁元素的叙述中正确的是
| A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| B.氢氧化铁可以由相应的物质通过化合反应而制得 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2O |
| D.铁元素位于周期表中第4周期ⅧB族 |
25°C时,下列关于分别由等体积0.1mol/L的2种溶液混合而成的溶液的说法中,不正确的是
| A.Ba(OH)2溶液与Na2SO4溶液:pH=13 |
| B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.Na2CO3溶液与NaOH溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+) |
| D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |