运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
②P(红磷,s)+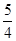 O2(g)=
O2(g)=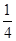 P4O10(s) ΔH=-738.5kJ·mol-1
P4O10(s) ΔH=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为
| A.P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1 |
| B.P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1 |
| C.P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1 |
| D.P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1 |
下列实验能达到预期目的的是()
| A.用浓氢氧化钠溶液除去氯气中少量的氯化氢 |
| B.加入稀硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| C.食盐中的碘可以直接用淀粉检验其是否存在 |
| D.用干燥的pH试纸可测得新制氯水的pH=2 |
已知A2-核内有x个中子,A原子的质量数为m,则ngA2-所含电子的总物质的量是(单位:mol)()
A.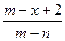 |
B.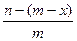 |
C.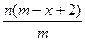 |
D.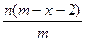 |
向饱和Na2CO3溶液中通入足量CO2,下列说法不正确的是()
| A.溶液中有Na2CO3·10H2O晶体析出 |
| B.溶液的pH减小 |
C.溶液中发生的离子反应为:CO2+H2O+CO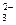 ===2HCO ===2HCO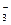 |
| D.溶液中Na+的物质的量减少 |
某些化学试剂可用于净水。水处理中使用的一种无机离分子混凝荆的化学式可表示为[Al2(OH)nClmyH2O]x,式中m等于()
| A.3—n | B.6-n | C.6+n | D.3+n |
NA为阿佛如德罗常数,下述正确的是()
| A.标准状况下,11.2L四氯化碳所含分子数为0.5 NA |
| B.1mol/L,的盐酸溶液中,所含氯化氢分子数为NA |
| C.80g硝酸铵含有氮原予数为2NA |
| D.1mol氯气和铁反应时转移的电子数为3NA |