近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下: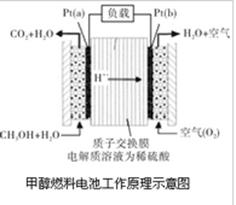
请回答下列问题:
(1)Pt(a)电极对应发生的电极反应为 。Pt(b)电极反生 反应(填“氧化”或“还原”),电极反应为 。
(2)电池的总反应方程式为 。
(3)如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有 mol。
在下列物质中是同系物的有;互为同分异构体的有;互为同素异形体的有;互为同位素的有;互为同一物质的有;
(1)液氯(2)氯气 (3)白磷 (4)红磷(5)氕 (6)氚
(7) 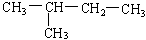 (8)
(8) 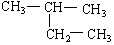
(9)CH2 = CH-CH3(10) 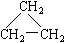 (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=已知: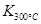 >
>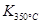 ,则该反应是热反应。
,则该反应是热反应。
(2)图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。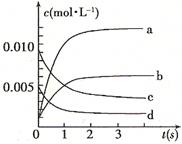
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
在2L密闭容器中充入1mol H2和1mol I2蒸气,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)==2HI(g) △H<0达到平衡时候n(H2)为0.8mol
(1) 保持容器容积不变,向其中加入1molH2,反应速率(填加快、减慢、不变、不确定),理由是。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率(填加快、减慢、不变、不确定),理由是。平衡(正向或逆向或不)移动
(3)计算该温度下的平衡常数
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: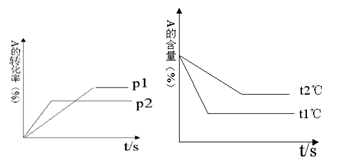
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);
(4)正反应为反应。
(1)Cu(NO3)2的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性,原因是(用离子方程式表示):____________。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。