A、B、C、D、E是中学常见的五种化合物,它们之间有下列转化关系: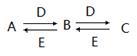
已知A溶液显碱性,焰色反应为黄色,且可促进水的电离。
(1)若A、B、C中含有相同的金属元素,则A的化学式为 ,D的化学式为 ;A、C反应生成B的离子方程式为 。
(2)若C是一种无色无味的气体,用离子方程式表示A溶液显碱性的原因_______________,C与E反应生成B的化学方程式为 。
环己烯常用于有机合成,现利用如图所示流程,以环己烯为原料合成六元环酯和合成橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。已知: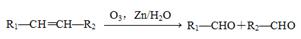
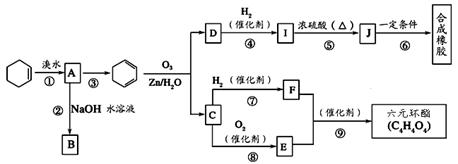
(1)B的名称是________________, ③的反应条件是。
(2)有机物B和I的关系为________(填序号)。
a.同系物 b.同分异构体 c.都属于醇类 d.都属于烃
(3)写出反应⑥反应化学方程式: 。
该六元环酯的结构简式为___________________________。
(4)任写一种D的属于酯类的链状同分异构体的结构简式: 。
(1)已知A~F是有机物,有下列转化关系。已知A是CH2=CH2的同系物,D能发生银镜反应,F的分子式是C6H12O2。(部分反应物或生成物及反应条件已略去):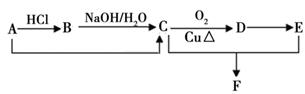
请写出下列反应的化学方程式:
①C→D:。
②C+E→F:。
③D与银氨溶液:。
(2)有机物甲的结构简式为: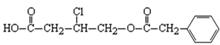
①甲在NaOH水溶液中加热,经酸化得到有机物乙和丙,丙是芳香族化合物。当1 mol甲与足量NaOH溶液发生反应时,最多消耗________molNaOH。
②1mol乙分别与足量金属钠和NaHCO3反应,生成的气体在相同状况下的体积比为。
(10分)已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,气体A相对于H2的密度为21,在下图变化中,中间产物F跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生红色沉淀,H有香味,I为高分子化合物。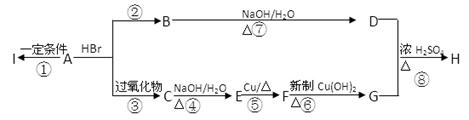
已知: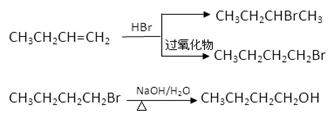
(1)写出下列各步变化的化学方程式(注明反应条件)
反应②_________________________________________________________;
反应⑤_________________________________________________________;
反应⑧_________________________________________________________。
(2)写出下列反应类型:
反应①_____________________,反应②_____________________,
反应⑤_____________________,反应⑧_____________________。
迷迭香酸是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,其结构如下图所示: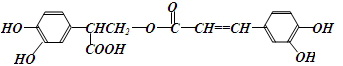
某同学设计了迷迭香酸的合成线路: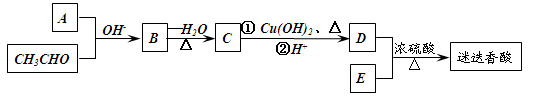
已知:①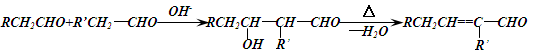
 、
、 表示烃基或氢原子;
表示烃基或氢原子;
②苯环上的羟基很难直接与羧酸发生酯化反应。
(1)A的分子式为。
(2)C的结构简式为。
(3)D、E反应的化学方程式为。
(4)与E互为同分异构体且同时满足下列条件的有机物有种。 任意写出其中的一种的结构简式。
要求:①苯环上共有四个取代基,且苯环上只有一种化学环境的氢原子;
②1mol该同分异构体分别与NaHCO3、NaOH反应时,最多消耗NaHCO3、NaOH的物质的量分别是1mol、4mol。
(共6分)常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________;
(2)化合物甲的电子式是_____________________________;
(3)化合物丙中存在的化学键是__________________________。