(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
HCHO(g)+H2(g)。CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;
实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,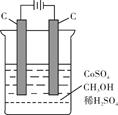
则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程为 。
以下是一些烷烃的燃烧热(kJ/mol)数据,回答下列问题:
| 化合物 |
燃烧热 |
化合物 |
燃烧热 |
| 甲烷 |
891.0 |
正丁烷 |
2 878.0 |
| 乙烷 |
1 560.8 |
异丁烷 |
2 869.6 |
| 丙烷 |
2 221.5 |
2甲基丁烷 |
3 531.3 |
(1)物质的能量越高越不稳定,比较正丁烷、异丁烷的热稳定性:正丁烷________异丁烷(填“>”或“<”)。
(2)写出表示乙烷燃烧热的热化学方程式:_________________________________
(3)相同质量的烷烃,碳的质量分数越大,燃烧放出的热量________(填“越多”“越少”或“相同”)。
二氧化碳“组合转化”的某烷烃碳架结构如图所示: ,此烷烃的一溴代物有种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为,
,此烷烃的一溴代物有种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为,
在乙醇的化学性质中,各反应的断键方式可概括如下: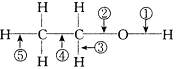
⑴消去反应:;⑵与金属反应:;
⑶催化氧化:;⑷分子间脱水:;
⑸与HX反应:。
莽草酸的结构式如图: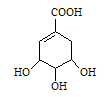 ,请回答:
,请回答:
(1)写出莽草酸分子中官能团名称。
(2)该有机物分子1moL最多能和moL NaOH发生反应。
以下是以莽草酸A为原料的有机合成路线: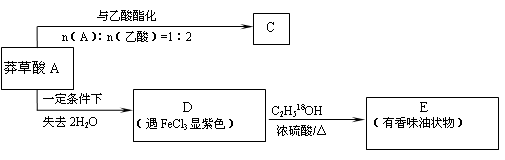
已知D的碳环上一氯代物只有两种。请继续回答下列问题:
(3)C有三种同分异构体,写出其中的一种结构简式。
(4)莽草酸A→D的反应类型是:。
(5)写出下列反应的化学方程式:
① D与足量的NaHCO3溶液反应;
② D→E。
根据下列的有机物合成路线回答问题: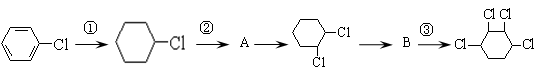
(1)写出A、B的结构简式:
A、B。
(2)写出各步反应类型:
①、②、③。
(3)写出②、③的反应方程式:
②,③。