下列离子方程式正确的是
| A.金属钠与水反应:Na +2H2O=Na++2OH-+ H2↑ |
| B.金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑ |
| C.稀硝酸中加入过量铁粉:Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2H2O |
| D.FeCl2酸性溶液放在空气中变质:4Fe2+ + 4H+ + O2 = 4Fe3+ + 2H2O |
对于原子半径的理解,不正确的是
| A.同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小。 |
| B.对于第三周期元素,从钠到氯,原子半径依次减小。 |
| C.各元素的原子半径总比其离子半径大。 |
| D.阴离子的半径大于其原子半径,阳离子的半径小于其原子半径。 |
食盐晶体是由钠离子(下图中的“º”)和氯离子(下图中的“•”)组成的,且均为等距离的交错排列。已知食盐的密度是2.2 g·cm-3,阿伏加德罗常数6.02×1023 mol-1。在食盐晶体中两个距离最近的钠离子中心间的距离最接近于
| A.3.0×10-8 cm |
| B.3.5×10-8 cm |
| C.4.0×10-8 cm |
| D.5.0×10-8 cm |
下列关于金属晶体的叙述正确的是
| A.常温下,金属单质都以金属晶体形式存在 |
| B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因变形而消失 |
| C.钙的熔沸点低于钾 |
| D.温度越高,金属的导电性越好 |
下列说法正确的是
①具有规则几何外形的固体一定是晶体
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
| A.①②⑤⑥ | B.③④⑥⑦ | C.②④⑦⑧ | D.③④⑤⑧ |
以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是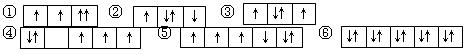
| A.① | B.①③ | C.②④⑤ | D.③④⑤ |