Cu2O是一种半导体材料,基于绿色化学理念设计的制取、制备Cu2O的电解池示意图如下图所示,电解总反应:2Cu+H2O===Cu2O+H2↑。下列说法正确的是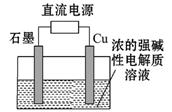
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极接直流电源的负极 |
| D.当有0.1 mol电子转移时,有0.1mol Cu2O生成 |
用如图所示装置进行实验,下列叙述不正确的是()
| A.K与N连接时,铁被腐蚀 |
| B.K与N连接时,石墨电极产生气泡 |
| C.K与N连接时,一段时间后溶液的pH增大 |
| D.K与M连接时,初始阶段石墨电极的电极反应为4OH--4e-===2H2O+O2↑ |
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/ min |
2 |
4 |
7 |
9 |
| n(Y)/ mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是()
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L· min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
为了探索外界条件对反应:aX(g)+bY(g) cZ(g)的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是()
cZ(g)的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是()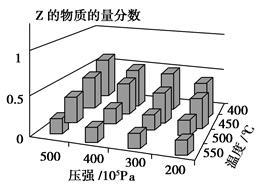
| A. ΔH<0,a+b>c | B. ΔH>0,a+b<c |
| C. ΔH>0,a+b>c | D. ΔH<0,a+b<c |
已知常温时CH3COOH的电离平衡常数为K。该温度下向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是()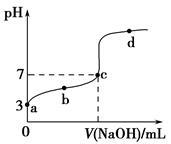
| A.a点表示的溶液中[CH3COO-]略小于10-3 mol·L-1 |
| B.b点表示的溶液中[CH3COO-]>[Na+] |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |
在一定条件下,Na2CO3溶液存在CO32-+H2O HCO3-+OH-平衡。下列说法不正确的是()
HCO3-+OH-平衡。下列说法不正确的是()
A.稀释溶液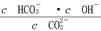 增大 增大 |
| B.通入CO2,溶液pH减小 |
C.升高温度,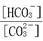 增大 增大 |
D.加入NaOH固体,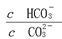 减小 减小 |