今有如下三个热化学方程式,关于它们的下列表述正确的是
H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l); ΔH== ckJ·mol-1,
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.a==b | D.2b==c |
已知:2H2(g) +O2(g) = 2H2O(g)ΔH =-483.6 kJ/mol 
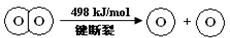
下列说法不正确的是
| A.H2(g) 中的H—H 键比H2O(g) 中的H—O 键牢固 |
| B.H2O(g)=H2(g) + 1/2O2(g)ΔH =" +241.8" kJ/mol |
| C.破坏1 mol H—O 键需要的能量是463.4 kJ |
| D.H2(g) + 1/2O2(g)=H2O(l)ΔH <-241.8 kJ/mol |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
| A.0.3 mol NO、0.1 mol NO2 |
| B.0.3 mol NO2、0.1 mol NO |
| C.0.6 mol NO |
| D.0.3 mol NO2 |
下列实验“操作和现象”与“目的或结论”对应关系正确的是
| 操作和现象 |
目的或结论 |
|
| A |
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向铁和稀硝酸反应后的溶液中若滴加KSCN溶液显红色;若滴加酸性高锰酸钾溶液紫红色褪去 |
该溶液中既有Fe3+,还有Fe2+ |
| C |
将铁插入硫酸铜溶液中 |
比较Cu、Fe2+的还原性 |
| D |
将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
检验碳与浓硫酸反应后的气体产物 |
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
若NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA |
| B.18gD2O中含有的质子数目为10NA |
| C.常温常压下,1mol氦气中含有的核外电子数为2NA |
| D.ag某气体含分子数为b,cg该气体在标况下的体积为22.4ab/(c NA) L。 |