W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XW4分子中,中心原子属于 杂化,分子的空间构型为 ;
根据电子云重叠方式的不同,分子里共价键的主要类型为 。
(3)写出Y原子价层电子的排布图
(4)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 。
 (12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下:
(12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下: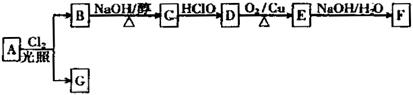
已知:
请回答下列问题:
(1)烷烃A只有2种同分异构体(包括A),则A的分子式是
(2)B和G均为一氯代烃,B发生消去反应时,有C和C′两种有机产物,而G发生消去反应时,只有一种有机产物C′。则C和C′的名称(系统命名)分别为,
(3)反应D→E的化学方程式为
(4)乙偶姻F的结构简式为
(5)任意写出2种能发生水解反应的乙偶姻的同分异构体的结构简式:
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。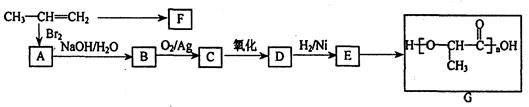
(1)聚合物F的结构简式是
(2)C与新制的Cu(OH)2共热转化为D的化学方程式是:
(3)D转化为E的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如右图所示: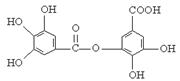
(1)1molA最多可与mol NaOH反应。
(2)A不具有的性质是(填写序号)。
①与FeCl3溶液发生显色反应②加聚反应
③与溴水发生取代反应④与碳酸氢钠溶液反应生成二氧化碳
⑤与溴水发生加成反应
(3)有机化合物B在浓硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式
(4)有机化合物C是合成治疗禽流感药物的原料之一,C可以看成是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式:
某同学称取淀粉溶于水,测定淀粉的水解百分率。其程序如下:(共9分)
(1)各步加入的试剂为:
A,B,C。
(2)加入A溶液而不加入B溶液是否可以,其理由是。
(3)当析出1.44g砖红色沉淀时,淀粉水解率是。
1mol 某气态烃完全燃烧,生成3mol二氧化碳和2mol水,则此烃的分子式是。