以下表示的是碳及其化合物的相互转化关系:C+CuO→CO2+Cu;CO2+H2O→H2CO3;H2CO3+Ca(OH)2→CaCO3+2H2O;CaCO3→CaO+CO2,其中涉及的基本反应类型依次为
| A.置换、化合、分解、复分解 | B.化合、置换、复分解、分解 |
| C.化合、置换、分解、复分解 | D.置换、化合、复分解、分解 |
已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-═2RO4n-+3Cl-+5H2O,则RO4n-中R的化合价是
| A.+3 | B.+4 | C.+5 | D.+6 |
下列离子方程式不正确的是()
| A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ |
| B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
| C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O═Fe(OH)3↓+3HClO |
| D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全: |
NH4++H++SO42-+Ba2++2OH-═NH3·H2O+BaSO4↓+H2O
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2SO4(s)+SO2(g) [N(CH3)4]2S2O6(s)
[N(CH3)4]2S2O6(s)
下列说法正确的是
| A.[N(CH3)4]+中只含共价键 |
| B.该反应中,SO2作氧化剂 |
| C.SO2漂白品红是利用其强氧化性 |
| D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6 |
下列实验装置或操作正确的是( )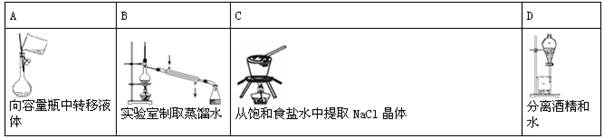
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫xmol.下列说法正确的是()
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为xmol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x)mol |