下列说法不正确的是
| A.NaOH属于强电解质是因为其可以完全电离 |
| B.电解质溶液可以导电是因为溶液中存在自由移动的离子 |
| C.工业上用电解熔融的氯化铝来制备金属铝 |
| D.碳酸钠溶液与澄清石灰水反应的离子方程式可表示为:Ca2++CO32-=CaCO3↓ |
下列说法正确的是
| A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 |
| C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中 |
| D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
化学与生产和生活密切相关,下列说法正确的是
| A.聚乙烯塑料的老化是因为发生了加成反应 |
| B.煤经过气化和液化等物理变化可转化为清洁燃料 |
| C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
下列叙述错误的是()
| A.1molX在浓硫酸作用下发生消去反应,最多生成3molH2O |
| B.1molY发生类似酯化的反应,最多消耗2molX |
| C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 |
| D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得: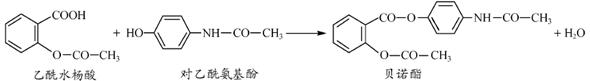
下列有关叙述正确的是()
| A.贝诺酯分子中有三种含氧官能团 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 |
| D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)()
| A.4种 | B.5种 | C.6种 | D.7种 |