用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
| A.碱式滴定管未用待测液润洗 |
| B.滴定过程中不慎有液体溅出 |
| C.滴定前仰视读数,滴定后读数正确 |
| D.酸式滴定管未用标准盐酸润洗 |
能说明醋酸是弱电解质的是()
①用浓硫酸和醋酸钠固体共热可制得醋酸 ②醋酸钠溶液呈碱性
③可以用食醋清除热水瓶内的水垢 ④pH=2醋酸溶液稀释1000倍后pH小于5
| A.② | B.①② | C.②④ | D.①③④ |
已知反应a W(g)= b Z(g)的△H < 0、△S > 0,对此反应叙述正确的是()
| A.该反应在任何情况下均能自发进行 |
| B.该反应在任何情况下均不能自发进行 |
| C.该反应在一定条件下能自发进行 |
| D.条件不足,无法判断 |
对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是()
| A.使用催化剂 | B.升高温度 |
| C.增大体系压强 | D.加入一种反应物 |
对于可逆反应:2SO2 + O2 2SO3(g)△H<0,升高温度产生的影响为()
2SO3(g)△H<0,升高温度产生的影响为()
| A.v正增大, v逆减小 | B.v正减小, v逆增大 |
| C.v正和v逆不同程度的增大 | D.v正和v逆同等程度的增大 |
下列热化学方程式或离子方程式中,正确的是()
| A.氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2 ↓ |
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)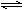 2NH3(g)△H= -38.6kJ·mol-1 2NH3(g)△H= -38.6kJ·mol-1 |
| C.甲烷的标准燃烧热△H= -890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g) + 2O2(g) = CO2(g)+2H2O(g) △H= -890.3kJ·mol-1 |
| D.氧化铝溶于NaOH溶液:Al2O3 + 2OH-=2AlO2-+ H2O |