I、常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
(2)已知在25℃时,CO32-水解反应的平衡常数(即水解常数用Kh表示)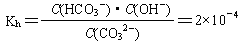
当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
(3)当混合液的pH=________时,开始放出CO2气体。
II、(1)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡____________________(填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为______________。
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(3)25 ℃时,将a mol NH4NO3溶于水,向所得溶液中滴加b L氨水后溶液呈中性,则所滴加氨水的浓度是________mol·L-1。(用含a 、b 的式子表示)(NH3·H2O的电离平衡常数取Kb=2×10-5 mol·L-1)
(16分)给出下列氧化还原反应,试回答下列问题。
(1) KMnO4+ KI+ H2SO4K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式
被还原的元素 ,发生氧化反应的物质。 (2) 3Cl2+ 6NaOH 5NaCl + NaClO3+ 3H2O
(2) 3Cl2+ 6NaOH 5NaCl + NaClO3+ 3H2O
用双线桥标出电子转移的方向和数目
氧化剂与还原剂的物质的量之比为,氧化产物是。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现性(填氧化或还原);11molP中被P氧化的P是mol
(共9分)
(1)0.5 mol H2O的质量为 g,其中含有个水分子,共有个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 _ ,在相同温度和相同压强条件下,体积最大的是,体积最小的是。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4g;需要CuSO4·5H2O _g。
(4)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的HCl、H2SO4、H3PO4溶液的体积比为。
(共5分)用于提纯或分离物质的方法有:
| A.萃取分液 | B.加热分解 | C.蒸发结晶 | D.分液 E、蒸馏 F、过滤、G渗析等,请将提纯或分离的序号填在后面横线上。 |
(1)分离饱和食盐水与泥沙的混合物 _____
_____
(2)分离水和汽油的混合物 _____
(3)海水淡化 ______
(4)从碘水里提取碘 ______
(5)除去氢氧化铁胶体中混有的氯离子、钠离子 ______
______
(共6分) 现有①二氧化硫②蔗糖(C12H22O11)③纯碱 ④铜 ⑤碘的酒精溶液⑥液溴 ⑦石墨 ⑧熟石灰⑨硫酸铝溶液⑩烧碱十种物质,若根据物质的组成或性质进行分类,则(填对应的编号) 下列各组物质中:
⑴属于“混合物”的是_______________⑵能“导电”的是_________
⑶属于“非金属单质”的是___________⑷属于“电解质”的是___________
⑸属于“非电解质”的是⑹属于“碱类物质”的是
根据图示填空
(1)化合物A中含氧官能团的名称是。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是
___________________________________________________。
(3)B在酸性条件下与Br2反应得到D,D的结构简式是 。写出D与NaOH溶液反应的化学方程式_________________________________________。
。写出D与NaOH溶液反应的化学方程式_________________________________________。
(4)F的结构简式是。