对于反应C(s)+H2O(g)  CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为K= |
| B.增大体系压强,平衡常数K不发生变化 |
| C.升高体系温度,平衡常数K减小 |
| D.增加C(s)的量,平衡正向移动 |
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是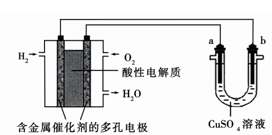
| A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是含锌、铁的粗铜,b极是纯铜, a极溶解铜的质量与b极析出铜的质量相等 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
下图各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为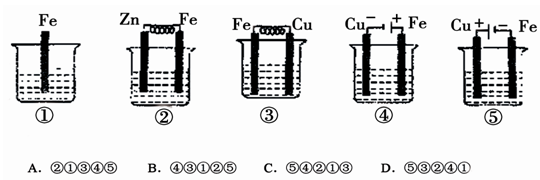
在下列各溶液中,离子一定能大量共存的是
| A.强酸性溶液中:K+、Al3+、CH3COO-、SO42- |
B.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO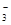 、Br-、Ba2+ 、Br-、Ba2+ |
| C.室温下,pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
下列叙述正确的是
| A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-) |
| B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生 |
| C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中
逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是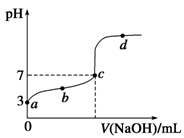
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中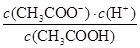 大于K 大于K |