(8分)胃酸(主要成分为盐酸)过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;
(2)能溶于水,水溶液呈弱碱性;
(3)遇酸及酸性药物则产生二氧化碳;
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。
(2)凝胶本身覆盖于溃疡面上,具有保护作用。
(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填中文名称);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的化学方程式: 。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式: ; 。
A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR’在酸性高锰酸钾溶液中反应生成RCOOH和R’COOH,其中R和R’为烷基)。
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为_▲;B的结构简式是_▲
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是▲,反应类型为_▲:
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是▲
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有▲种,其相应的结构简式是▲
(1)苏合香醇可以用作食用香精,其结构简式如图所示。
苏合香醇的分子式为,它不能发生的有机反应类型有(填数字序号)。
①取代反应 ②加成反应 ③氧化反应 ④加聚反应
(2)苏合香醇属于酚类有机物的同分异构体共有种
(3) 的同分异构体有多种,满足下列条件的共有种。
的同分异构体有多种,满足下列条件的共有种。
① 苯环上只有两个取代基
② 1 mol 与足量的NaHCO3溶液反应生成2 mol CO2气体
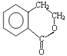
某有机化合物A因其具有麻醉作用,常用作局部麻醉剂和镇痛剂。它的结构简式如右图所示,请回答:
(1) A的分子式是 ▲ 。
(2) 有机物A不能发生的化学反应有(填序号) ▲ 。
a.加成反应 b.水解反应
c.加聚反应 d.氧化反应
(3)满足下列条件的A的同分异构体有▲种,写出其中一种的结构简式▲。
①能与碳酸氢钠溶液反应;
②核磁共振氢谱显示有四种类型氢原子的吸收峰
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D 三种物质。
,它可通过不同化学反应分别制得B、C和D 三种物质。

B C D
(1)B中的含氧官能团名称是 ▲、▲ 。
(2)C→A的反应类型是 ▲;A~D中互为同分异构体的是 ▲ 。
(3)由A生成B的化学方程式是 ▲ 。
(4)C在一定条件下发生加聚反应的化学方程式是 ▲ 。
下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法。填表(填入序号):
B:(1)CaO;(2)NaOH溶液;(3)溴水; (4)饱和Na2CO3;(5)水
C:(1)重结晶;(2)洗气;(3)蒸馏(4)分液。
| 物质 |
加入试剂 |
操作方法 |
| ①粗苯甲酸的提纯 |
▲ |
▲ |
| ②乙醇(水) |
▲ |
▲ |
| ③乙酸乙酯(乙酸) |
▲ |
▲ |
| ④乙烷(乙烯) |
▲ |
▲ |
| ⑤苯(酒精) |
▲ |
▲ |