(选考)【化学——选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_____________,该能层具有的原子轨道数为____________________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是____________________。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
下图表示的是A-E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E反应的离子方程式。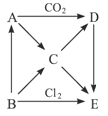
(1)A______B________C_______D________E_________
(2)B→C_______________C→D_________________D→E___________________
阅读如下信息后完成问题:元素M是仅次于铁而在生物细胞中大量存在的金属元素,是人体必需元素之一;M用于制合金、白铁、干电池、烟火等;其粉末为强还原剂,可用于有机合成、染料制备以及金、银的冶炼;其氧化物是一种白色颜料。
(1)M的元素符号是_______________,核外电子数有_______________个。
(2)M的最重要的两种矿物的化学式是_______________和_______________。
(3)M的最重要的一种“矾”的名称是_______________,化学式是________________。
(4)M能否与强酸(HCl)或强碱(NaOH)反应。如果能,写出离子方程式。
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg=Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_______________价。
(2)以上反应中的氧化剂为_____________________,当有1 mol CuI参与反应时,转移电子_______________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式: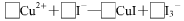
埋藏在地下的青铜器锈蚀过程可以表示为:
(1)青铜器锈蚀过程中的产物有__________________________________________________。
(2)青铜器出土后防止青铜器继续锈蚀的关键是____________________________________。