(15分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。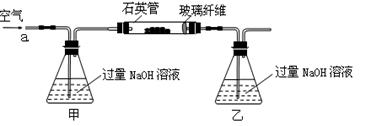
其反应的化学方程式为:4FeS2+11O2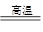 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2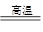 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理: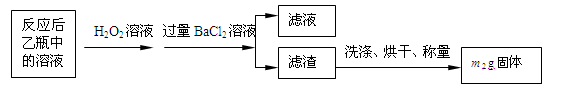
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】测定铁元素的含量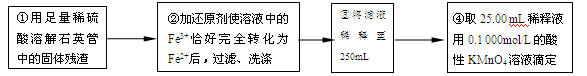
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.03 |
20.00 |
24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
某研究性学习小组利用如图所示装置完成有关实验。
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入。装置Ⅱ从管口进气可作为氨气的收集装置。实验过程中,使用分液漏斗滴加液体的操作是。
(2)该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
(3)实验中若需用所给装置量取NH3的体积,试简述操作方法
所装液体最好是____(填字母编号)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
本实验应对量气装置多次读数,读数时应注意:①将实验装置恢复到室温,②,③视线与凹液面最低处相平。
【实验二】比较盐酸、碳酸、硅酸的酸性强弱(可以不填满,也可以再加行)
(4)用所给装置设计实验,完成下列表格
装 置序号 置序号 |
仪器中所加物质名称 |
目的或现象 |
用下列两个装置分别进行苯的硝化和苯酚跟甲醛的缩聚实验.
(1)(甲)装置适用于进行 实验.,本实验需要的药品为6
实验.,本实验需要的药品为6 3%
3% 的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
若温度控制在50—600C,其反应的化学方程式为————————;
(2)(乙)装置适用于进行实验.,其化学方程式为—————。
(3)写出苯酚与浓溴水反应的化学方程式
(2分)下列实验操作不正确的是________。
陇东中学高三2、4班学生设计了以下 实验方案验证Ag与浓HNO3反应的
实验方案验证Ag与浓HNO3反应的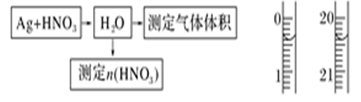
⑴测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶 液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置
液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置 如上图所示。在B容器中生成硝酸的物质的量为__
如上图所示。在B容器中生成硝酸的物质的量为__ __________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
⑵测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是____________________________________________________________
__________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________________________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是________________________________。
固态化 合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。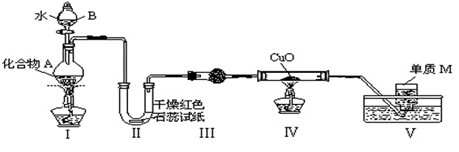
(1)仪器B的名称是____________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有气体M生成,则Ⅳ发生反应的化学方程式为______________________________;Ⅲ中的试剂为__________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ——Ⅲ——Ⅳ——Ⅱ——Ⅴ,此时Ⅱ中现象为__________________,原因是_______________________________________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为_____________。