【化学—选修3:物质结构与性质】
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。
则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s)△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s)△H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3−=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量为0.6 mol反应中转移电子的数目为,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示。
②滴加过程中,溶液中微粒浓度大小关系正确的是(填字母)。
a.c(Na+)= c(H2S)+c(HS−)+2c(S2−)
b.2c(Na+)=c(H2S)+c(HS−)+c(S2−)
c.c(Na+)=3[c(H2S)+c(HS−)+c(S2−)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为。
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
① 写出反应器中发生反应的化学方程式是。
② 电渗析装置如图所示,写出阳极的电极反应式。该装置中发生的总反应的化学方程式是。
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)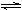 NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g) 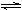 H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向(填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化(填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 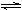 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因
有机物H是用于合成药物的中间体,G为合成涤纶。请根据下列转化关系回答有关问题: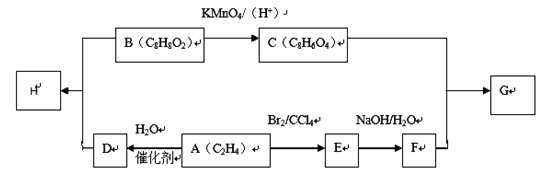
已知以下信息:
①B能与碳酸氢钠溶液反应产生二氧化碳,其苯环上一氯代物只有2种
②G为C和F一定条件下1:1反应生成的高分子化合物
③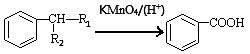 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)
(1)A的化学名称为 ;C中含氧官能团名称为 。
(2)H的结构简式为 ;A→D的反应类型为 。
(3)写出C和F反应生成高分子化合物的化学方程式 。
(4)同时符合下列条件的B的同分异构体共有 种(不考虑立体异构);
①能发生银镜反应②含有苯环结构③能在碱性条件下水解
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:
⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
⑵如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
⑶在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______ ______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ; F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。