W、X、Y、Z是核外电子层数相同且原子序数依次增大的短周期元素,W、X是金属元素,Y的氢化物为H2Y,Z的某种含氧酸有漂白性。W、X的最高价氧化物对应的水化物可以发生反应生成盐和水。下列判断正确的是
| A.X的金属性强于W的金属性 |
| B.W、X分别与Z形成的化合物都是离子化合物 |
| C.W、X、Y、Z的简单离子的半径:Y>Z>W>X |
| D.Y的氧化物通入含有Z单质的溶液中,一定无明显变化 |
设NA表示阿伏加德罗常数,下列说法正确的是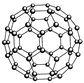
| A.标准状况下1molHCl与HF的混合物的体积约为22.4L |
| B.N60结构如右图,28gN60单质中含有的N-N键个数为NA |
| C.1.72g生石膏(CaSO4·2H2O) 转化为熟石膏(2CaSO4·H2O) 失 去的结晶水数目为0.015NA |
| D.9 g重水所含有的电子数为5NA |
常见的污染物可分为一次污染物和二次污染物,二次污染物是排入环境中的一次污染物在物理化学因素或微生物的作用下,发生变化所生成的新污染物,如反应2NO+O2====2NO2中,二氧化氮为二次污染物。下列4种气体中:①硫化氢,②二氧化硫,③汽油,④氯气,其中能生成二次污染物的是( )
| A.①② | B.①②④ | C.②③ | D.全部 |
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程上来,其首要原因是( )
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.不使电池中渗泄的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |
“绿色化学”是人们最近提出的一个新概念,主要内容之一是从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用。下列化学反应符合“绿色化学”概念的是( )
A.制CuSO4:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
| B.制CuSO4:2Cu+O2====2CuO,CuO+H2SO4(稀)====CuSO4+H2O |
| C.制Cu(NO3)2:3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O |
| D.制Cu(NO3)2:Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O |
你认为可以减少酸雨产生的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |