25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是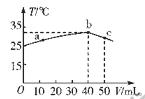
| A.HA溶液的物质的量浓度为0.0l mol·L—1 |
| B.b→c的过程中,温度降低的原因是溶液中发生了吸热反应 |
| C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) |
| D.25℃时,HA的电离平衡常数K约为1.43×10—2 |
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是
| A.d曲线代表溶液中Br-变化情况 |
| B.原溶液中FeI2的物质的量为2 mol |
| C.原溶液中n(Fe2+):n(Br-)=2:3 |
| D.当通入2 mol Cl2时,溶液中离子反应为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
已知反应:10AgF+5Cl2+5H2O===9AgCl+AgClO3+10HF+O2,下列关于该反应的叙述不正确的是
| A.该反应中,氧化剂与还原剂物质的量之比为9:5 |
B.当反应中有1 mol电子转移时,被还原氯气物质的量为 mol mol |
| C.每产生1 mol O2时,被氧元素还原的氯气物质的量为2 mol |
D.参加反应的水有 被氧化 被氧化 |
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
| A.5种 | B.6种 | C.7种 | D.8种 |
苹果酸的结构简式为 ,下列说法正确的是
,下列说法正确的是
| A.苹果酸中能发生酯化反应的官能团有2种 |
| B.1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C.1 mol苹果酸与足量金属Na反应生成1 mol H2 |
D.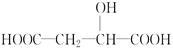 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |