黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为:2CuFeS2+O2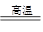 □+2FeS + SO2 (已配平),则下列关于该反应的说法错误的是
□+2FeS + SO2 (已配平),则下列关于该反应的说法错误的是
| A.方框中的物质应为Cu2S |
| B.该反应的部分产物可用于硫酸工业 |
| C.反应中O2只做氧化剂,CuFeS2只做还原剂 |
| D.反应中若有1 mol SO2生成,则一定有6 mol电子发生转移 |
已知在298K时的有关数据:C(s)+1/2O2(g)===CO(g);ΔH1=-110.5kJ·mol-1;
C(s)+O2(g)===CO2(g);ΔH2=-393.5kJ·mol-1。则C(s)+CO2(g)===2CO(g)的ΔH为( )
| A.+283.5kJ·mol-1 | B.+172.5kJ·mol-1 |
| C.-172.5kJ·mol-1 | D.-504kJ·mol-1 |
已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ.则下列说法中正确的是( )
| A.氢气的燃烧热为241.8 kJ/mol |
| B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量 |
| C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ/mol |
| D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量 |
下列情况下,反应速率相同的是
| A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 |
| B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应 |
| C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应 |
| D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为()。
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是 ( )
| 实验 |
反应温度/℃[ |
Na2S2O3溶液 |
稀H2SO4 |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |