已知下列热化学方程式
⑴C(s)+1/2O2(g)=CO(g) △H1="-110." 5kJ/mol
⑵2H2(g)+O2(g)=2H2O(g) △H2=-483.6 kJ·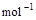
由此可知C(s)+ H2O(g) ="=" CO(g) + H2(g) ΔH3。则 ΔH3等于
| A.+131.3kJ·mol-1 | B.-131.3kJ·mol-1 |
| C.+373.1kJ·mol-1 | D.-373.1kJ·mol-1 |
为了加强再生资源的回收管理,节约资源,保护环境。《上海市再生资源回收管理办法》从2012年12月1日起施行。下面是4位同学对一些废品按其主要成分进行的分类,其中错误的是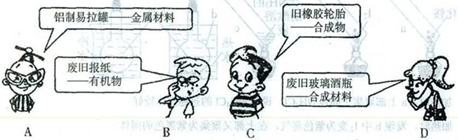
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列说法止确的是 ( )
| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是 ( )
| A.1 L 1 mol•L-1的HAc溶液中含有氢离子数约为6.02×1023 |
| B.18 g D2O(重水)完全电解,转移的电子数约为6.02×1023 |
| C.标态下,22.4L NO2气体,所含氧原子数约为2×6.02×1023 |
| D.标态下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023 |