镍镉(Ni—Cd)可充电电池在现代生活中有着广泛的应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2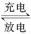 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是
Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是
| A.弱碱的浓度大于强酸的浓度 |
| B.反应后的溶液呈酸性 |
C.原氨水中有1%的含氮微粒为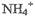 |
D.反应后的溶液中 三种微粒的平衡浓度之和为 三种微粒的平衡浓度之和为 |
下列叙述正确的是
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2mo1/L的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
下列溶液一定呈中性的是
| A.pH=7的溶液 |
| B.c(H+)=c(OH-)的溶液 |
| C.由强酸、强碱等物质的量反应得到的溶液 |
| D.非电解质溶于水得到的溶液 |
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g);△H<0,下列结论中不正确的是
pC(g)+qD(g);△H<0,下列结论中不正确的是
A、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度变为原来的2.1倍,则m+n<p+q
B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到平衡时,气体的总物质的量等于2a
D、若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来1/2要小
反应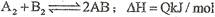 ,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
,在不同温度和压强改变的条件下,产物AB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是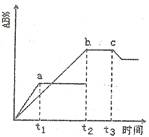
| A.A2、B2及AB均为气体,Q>0 |
| B.AB为气体,A2、B2中有一种为非气体,Q>0 |
| C.AB为气体,A2、B2中有一种为非气体,Q<0 |
| D.AB为固体,A2、B2中有一种为非气体,Q>0 |