某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去)。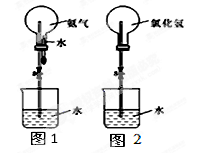
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氯化氢气体应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)如果用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,打开止水夹,挤出胶头滴管中的水引发水上喷。该实验的原理 是 。
(4)如果用图2装置进行喷泉实验,上部烧瓶已装满干燥氯化氢气体,请说明引发喷泉的方法 。
(5)若至喷泉实验停止时,图1中剩有烧瓶容积1/5的气体;图2烧瓶中剩有烧瓶容积1/4的气体;则图2烧瓶中盐酸的物质的量浓度为 (两种气体均在标准状况下收集);图1烧瓶中氨水的物质的量浓度 (填“大于”、“小于”、“等于”)图2烧瓶中盐酸的物质的量浓度。
下列除杂质的操作中不正确的是……( )
| A.镁粉中混有铝粉,加入过量烧碱溶液充分反应、过滤 |
| B.SO2中混有NH3,将其通过足量浓硫酸 |
| C.氯气中混有氯化氢气体,将其通过碱石灰 |
| D.Al(OH)3中混有Mg(OH)2,加入足量烧碱溶液后过滤,向滤液中通入过量CO2后过滤 |
简答下面有关标准氢氧化钠溶液滴定待测盐酸的问题。
(1)盛放待测盐酸的锥形瓶下方垫一张白纸的作用
________________________________________.
(2)用酚酞作指示剂,滴定到达终点时,溶液颜色变化是
___________________________________.
(3)有下列错误操作:
①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准氢氧化钠溶液;
②用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失;
③滴定前,读碱液体积时视线低于碱式滴定管中的液面,滴定后读出碱液体积时,视线高于碱式滴定管中的液面;
④锥形瓶用待测酸液润洗两次。
哪些错误操作会使盐酸浓度的测定值偏低?答:__________________;
哪些错误操作会使盐酸浓度的测定值偏高?答:___________________.
(4)如果用甲基橙代替酚酞作指示剂,此时所得盐酸浓度的测定值比用酚酞作指示剂测出的稍大还是稍小?答:
_________________________________________________________。
某同学中和滴定实验的过程如下:
| A.取一支碱式滴定管, |
| B.用蒸馏水洗净, |
| C.加入待测的NaOH溶液, |
| D.记录液面刻度读数, |
(E)用酸式滴定管精确放出定量标准酸液,
(F)置于未经标准酸液润洗得洁净锥形瓶中,
(G)加入适量蒸馏水,
(H)加入酚酞试液2滴,
(I)滴定时,边滴加摇荡,
(J)边注视滴定管液面的变化,
(K)当小心滴到溶液由无色变成粉红色时,停止滴定。
(L)记录液面刻度读数,
(M)根据滴定管的两次读数得出NaOH溶液体积为22mL,
指出上述实验过程中的错误之处(用编号表示)____________________。
(附:你知道各项错误的原因吗?)
取2g干燥铝粉和3g碘粉小心混匀,分为四堆。往各堆上分别加0.5g水,1g明矾,1g胆矾,1g无水硫酸铜。加水那堆首先冒火花,发生剧烈反应,其次发生反应的是加明矾的那一堆,再次是加胆矾的发生反应,而加无水硫酸铜的那一堆最难发生反应。
(1)铝和碘反应的方程式为_________________________;
(2)铝和碘反应还可以看到的现象是_________________________;
(3)四堆混合物发生反应的先后顺序说明:①_________,②____________。