
根据下图回答问题。
①仪器名称:a (10) 、b (11) 。
②实验室用大理石和稀盐酸制取二氧化碳,选用装置C优于B的原因是 (12) ;收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到 (13) ,说明已集满。
③取一朵用紫色石蕊试液染成紫色的干燥小花,将小花的一半用水喷湿,放入装置D中,观察到的实验现象是 (14) ,此现象说明CO2具有的化学性是 (15) (用化学方程式表示)。
④装置E中镁条能在CO2中剧烈燃烧,发出白光,放热,产生白色固体和黑色固体,反应的化学方程式
是 (16) 。
⑤欲测定鸡蛋壳中碳酸钙的质量分数。取12.5g干燥的碎鸡蛋壳放入烧杯中,向其中加入40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外其他成分均不与稀盐酸反应产生气体),反应后烧杯中物质的总质量为48.1g。计算:
Ⅰ.反应产生二氧化碳的质量为 (17) g;
Ⅱ.鸡蛋壳中碳酸钙的质量分数 (18) (通过化学方程式列式计算)。
工业上用电解氯化镁方法生产金属镁:MgCl2通电Mg + Cl2↑。现电解950Kg氯化镁最多能生产多千克单质镁?同时能得到多少千克氯气?
根据硝酸铵(NH4NO3)计算。
(1)相对分子质量为。
(2)求硝酸铵中N、H、O元素之间的质量比为。
(3)求硝酸铵(NH4NO3)中氮元素的质量分数为。
(4)经测定某块农田缺氮元素210g,则需施用纯净的NH4NO3克?
用下图气体发生装置制取二氧化碳,小明把石灰石和100克稀盐酸装进发生器中,用天平称量发生器和里面物质的总质量,发现总质量的减小值m与反应时间t的关系如图所示,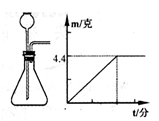
反应结束后还有少量石灰石剩余。
请根据图像完成下列各题:
(1)最终生成二氧化碳的质量为克。
(2)所用稀盐酸的溶质质量分数是多少? (要求列式计算)
(3)反应后溶液的质量为克。
(4)要配置实验所用的稀盐酸需37%、密度为1.18克/cm3的浓盐酸毫升
实验室有一瓶质量分数为19.6%的稀硫酸,请回答:
(1)配置200g这种溶液需 g溶质质量分数为98%的硫酸。
(2)现取10g配置好的稀硫酸,向其中滴加溶质质量分数为10%的氢氧化钠溶液,恰好完全反应后,需要溶质质量分数为10%的氢氧化钠溶液质量是多少?
冶炼2000t含杂质3%的生铁,需要含Fe3O490%的磁铁矿石多少吨?