下列实验方案不能达到实验目的的是
| |
实验目的 |
实验方案 |
| A |
证明溴乙烷发生消去反应有乙烯生成 |
向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B |
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
| C |
检验蔗糖水解产物具有还原性 |
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D |
测定铝箔中氧化铝的含量 |
取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下) |
下列关于非金属元素的叙述中正确的是
| A.非金属元素的原子最外层电子数都大于或等于4 |
| B.非金属元素的原子都易得电子生成相应的阴离子 |
| C.只由非金属元素组成的晶体一定属于分子晶体 |
| D.每一个主族包含的元素中不一定都有非金属元素 |
下列表示物质结构的化学用语或模型中,正确的是
A.HF的电子式: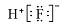 |
B.Cl—离子的结构示意图: |
C.8个中子的碳原子的核素符号: |
D.CH4分子的球棍模型: |
化学与生产、生活、社会密切相关。下列有关说法中,错误的是
| A.今夏,湖北地区出现了严重的旱情,缓解旱情的措施之一是用碘化银进行人工增雨 |
| B.新能源汽车的推广与使用有助于减少光化学烟雾的产生 |
| C.利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” |
| D.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的单质硅 |
纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
下列说法不正确的是
| A.保存溶液A时,应加入少量铁粉 |
| B.其制备反应类型不属于氧化还原反应 |
| C.取滤液进行焰色反应,火焰为黄色 |
| D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1 |
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是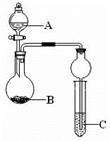
| A.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝 |
| B.若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中产生白色沉淀 |
| D.若A为浓硫酸,B为炭,C中盛有品红溶液,则C中溶液红色褪色 |