有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O) |
| C.向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D.向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
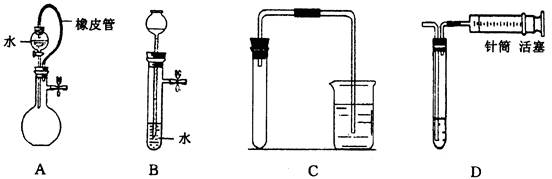
对下列装置,不添加其他仪器无法检查气密性的是()

地壳中含量第一和第三的两元素形成的化合物不具有的性质是()
| A.熔点很高 | B.与铁在高温下发生放热反应 |
| C.能溶于氢氧化钠溶液 | D.熔融后可以导电 |
下列实验操作正确的是()
A.中和滴定,锥形瓶用待测液润洗后再使用 |
B.中和热的测定,读取混合溶液的最高温度为终止温度 |
C.实验室制氯气,用饱和食盐水吸收尾气 |
| D.蔗糖的水解,在蔗糖溶液中加稀硫酸加热,再加入银氨溶液验证水解产物 |
我国科学家在世界上第一次为一种名为“钴酞箐”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞箐”分子的结构和性质与人体内的血红素和植物的叶绿素非常相似。下列关于“钴酞箐”分子的说法中正确的是()
A.它的分子直径比Na+小 |
B.它的分子既能透过滤纸,也能透过半透膜 |
C.在水中形成的分散系能产生丁达尔效应 |
| D.在水中所形成的分散系属悬浊液 |
下列有关苯酚的叙述中不正确的是()
| A.苯酚是酸,它能与NaOH溶液反应 | B.苯酚钠溶液中通入CO2气体可得苯酚 |
| C.苯中混有的少量苯酚可用乙醇除去 | D.苯酚有毒,但药皂中常掺有少量苯酚 |