海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案: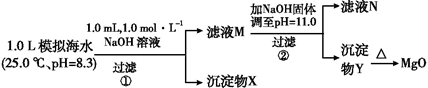
| 模拟海水中的离子浓度/mol·L-1 |
Na+ |
Mg2+ |
Ca2+ |
Cl- |
HCO3- |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6 ,Ksp(Ca(OH)2)=4.68×10-6,Ksp(Mg(OH)2)=5.61×10-12
下列说法不正确的是
A.沉淀物X为CaCO3、MgCO3
B.滤液M中存在Mg2+、Ca2+
C.滤液N中存在Ca2+、没有Mg2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2
观察下列几个装置示意图,有关叙述正确的是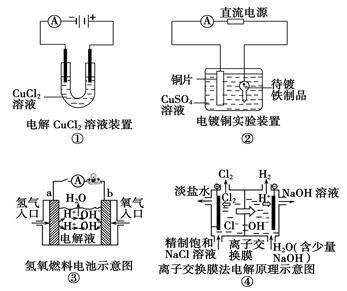
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③中外电路电子由a极流向b极 |
| D.装置④中的离子交换膜允许阳离子、阴离子、水分子自由通过 |
某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
| A.H2O2的分解反应为放热反应 |
| B.FeCl3是H2O2分解反应的催化剂 |
| C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多 |
| D.将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同 |
按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是
| A.F表示反应生成Cu的物质的量 |
| B.E表示反应生成O2的物质的量 |
| C.E表示反应实际消耗H2O的物质的量 |
| D.F表示反应生成H2SO4的物质的量 |
已知外电路中,电子由铜流向a极。有关下图中装置分析合理的一项是
| A.一段时间后锌片质量减少 |
| B.该装之中Cu极为正极 |
| C.b极的电极反应式:H2—2e—=2H+ |
| D.当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出。符合这一情况的是附表中的
| a极板 |
b极板 |
X电极 |
Z溶液 |
|
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |